Nivel de energía
- Los niveles de Capa de Electrones o Energía serán las distancias especificadas desde el núcleo de un átomo donde se pueden encontrar electrones o la probabilidad más alta de encontrarlos. Los electrones son partículas cargadas negativamente dentro de una molécula que se mueven alrededor del núcleo positivo, generalmente ubicado en el centro. Los niveles de energía son algo así como las medidas de los saltos de electrones de un paso.
- En la mayoría de los conceptos fundamentales de un átomo; consisten en electrones que orbitan alrededor de un núcleo.
- Sin embargo, los electrones no son capaces de elegir ninguna órbita según su deseo. Los electrones están restringidos a órbitas con solo un cierto nivel de energía. Los electrones solo pueden saltar de un nivel de energía o pasar a otro nivel. Los electrones no pueden orbitar con otras energías que no sean los niveles de energía especificados.
¿Qué es el diagrama de niveles de energía?
Los medios de nivel de energía para evaluar la cantidad de energía que los electrones pueden requerir y se liberarán durante la transición, si saltan de una órbita a otra. El suelo o el estado cero es el estado de energía mínimo calculado para H2 .

¿Cuáles son los cuatro niveles de energía?
Hay cuatro tipos de orbitales: p, d y f.
- Sharp-s
- Principio-p
- Difundido
- Fundamental-f
En un átomo, hay algunas combinaciones de estos orbitales.
El nivel de energía es una cantidad de espacio o regiones, siempre que electrones probablemente estará presente. Estas distancias, conocidas como orbitales, tienen diferentes formas, indicadas por una letra (s, p, d, f).

Friki3, Nubes-atómicas-orbitales spdf m0, CC BY-SA 4.0
¿Cómo se determinan los niveles de energía?

bruceblaus, Blausen 0342 ElectronEnergyNiveles, CC BY 3.0
electrones de valencia
"Los electrones que están en el nivel de energía más alto se llaman electrones de valencia".
Estado fundamental
“El estado de equilibrio de energía mínima del H2 el átomo se reconoce como el estado fundamental ".
Estado emocionado
Cuando el electrón (o átomo) tiene una energía más alta que esta energía más baja, se dice que está en un "estado excitado".
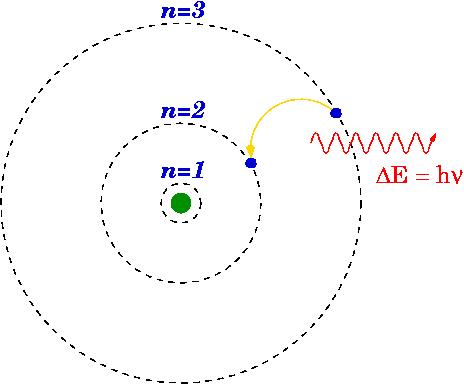
Si un electrón cae de un nivel superior a uno inferior, es posible que se emita un fotón o que se libere energía.
Diferencia energética
La energía del fotón emitido es la diferencia entre los niveles de energía del primario (n i ) y final (n f ) Expresar. La energía del fotón emitido se calcula utilizando la fórmula de Rydberg.
El modelo de hidrógeno de Bohr
En 1913, Niels Bohr conceptualizó los niveles de energía y la frecuencia espectraln de la H2 al considerar varios supuestos simples para fijar el hipotético clásico. La mayoría de estos defectos fueron resueltos por la modificación de Arnold Summerfield del modelo de Bohr. Por este modelo, el físico Niels Bohr ha recibido el Premio Nobel de Física en el año 1922.
En el concepto fundamental de que un átomo (el modelo atómico de Bohr), los electrones están rotando solo ciertas órbitas alrededor del núcleo. Los electrones suben y bajan entre las órbitas permitidas, además de la emisión o absorción de energía.
Aunque este modelo básico no se acepta bien porque la mayoría de la estructura de los átomos es más complicada que el hidrógeno, aunque esto requiere nuevos temas, de ahí la introducción de la mecánica cuántica, en la mecánica cuántica, cada electrón en órbita se explica mediante una expresión matemática conocida como una función de onda.
SauceW, Modelo de átomo de Bohr, CC BY-SA 3.0
Radio de Bohr
“El radio de Bohr (a0) es un parámetro constante, es igual a la distancia más predecible para el átomo de hidrógeno entre el núcleo y el electrón en el estado fundamental (no relativista y con un protón infinitamente pesado)"
Lleva el nombre de Niels Bohr debido a su parte en el modelo de Bohr de un átomo.

SE3-29X, Hidrógeno GIF, CC BY-SA 4.0
Lineas espectrales
Cada componente tiene un conjunto particular de niveles de energía. Así, las frecuencias en las que absorbe y emite luz se comportan como una especie de micrófono, identificando el compuesto específico y particular. Estas características de los átomos han permitido investigar en temas llamados espectroscopia, ciencia dedicada a identificar moléculas y átomos a partir del tipo de radiación que absorben o emiten.
Serie Balmer
El físico atómico Balmer ha observado analíticamente una relación en las energías durante la liberación de fotones del átomo. Las diversas energías / longitudes de onda de fotones discretas que fueron descubiertas por Balmer se denominan series de Balmer.
Más tarde se supo que las transiciones de energía crean las líneas de Balmer a partir del átomo de hidrógeno. El modelo de Bohr del átomo logró explicar la serie de Balmer porque las órbitas más grandes necesitaban electrones para tener una potencia significativamente más adversa o energía negativa para equilibrarse con el momento angular. La fórmula de Rydberg tiene una visión amplia de la serie Balmer para todos los ajustes de nivel de energía.
Espectro de emisión
La espectro de emisión del hidrógeno atómico se dividió en numerosas series espectrales y longitudes de onda proporcionadas por la fórmula estándar de Rydberg. Estas líneas espectrales detectadas son el resultado de la transición de electrones desde diferentes niveles de energía en un átomo.
Un espectro de emisión denota la variedad de longitudes de onda emitidas por un átomo o compuesto químico estimulado por calentamiento o corriente eléctrica. El espectro de emisión de gas en combustión u otras moléculas también podría utilizarse para ejemplificar su composición.
Crédito de la imagen: Ranjithsiji, Espectro de emisión atómica de helio, CC BY-SA 4.0
Energía potencial
“Esta es la energía de una entidad por su posición relativa a otros objetos, tensiones, carga eléctrica almacenada u otros factores dentro de sí mismo ".
Energía de unión
"La energía de enlace es la energía mínima necesaria para mantener unido un núcleo".
Energía de ionización
"La cantidad de energía que un átomo aislado en el estado electrónico fundamental necesitaba ser absorbido para descargarse como un e- "
La energía de ionización se describe como un paso de dificultad para eliminar un electrón en un átomo o ión o la habilidad de un átomo o ión para entregar un electrón. El no de reducción de electrones suele tener lugar en el estado fundamental de la especie.
Las energías de ionización se miden en kJ / mol, o la cantidad de energía que se requiere para que todos los átomos de un mol se aflojen, unidad e- respectivamente.
¿Cómo funciona la energía de ionización?
La energía de ionización es la energía requerida, en la que un átomo gaseoso aislado del estado electrónico fundamental debe absorber para liberar un electrón. Cuantos más electrones se pierdan, más + ve será este ion y será más difícil separar el e- del átomo.
¿Qué elemento tiene la energía de ionización más alta y más baja?
- El elemento tiene la mayor energía de ionización.
- El francio tiene la mínima energía de ionización.
La energía de ionización de un elemento aumenta de izquierda a derecha en una tabla periódica y disminuye de arriba hacia abajo generalmente en la tabla periódica.
cdang y adrignola, Tabla periódica de la energía de ionización, CC BY-SA 3.0
Para más información sobre la nube de electrones Haga clic aquí
Lea también
- ¿Es la energía potencial energía almacenada?
- Tipos de energía cinética
- Ejemplo de energía eléctrica a energía radiante.
- Ejemplo de energía mecánica a eléctrica
- Energía gravitacional a energía mecánica.
- Fórmula de energía eólica
- ¿La masa afecta la energía potencial?
- Energía radiante a energía química.
- Energía química a energía sonora.
- Ejemplo de energía cinética a sonora.

Soy Subrata, Ph.D. en Ingeniería, más específicamente interesado en los dominios relacionados con la ciencia nuclear y energética. Tengo experiencia en múltiples dominios, desde ingeniero de servicio para accionamientos electrónicos y microcontroladores hasta trabajos especializados de I + D. He trabajado en varios proyectos, incluida la fisión nuclear, la fusión con energía solar fotovoltaica, el diseño de calentadores y otros proyectos. Tengo un gran interés en el dominio de la ciencia, la energía, la electrónica y la instrumentación, y la automatización industrial, principalmente debido a la amplia gama de problemas estimulantes heredados de este campo, y cada día cambia con la demanda industrial. Nuestro objetivo aquí es ejemplificar estas materias científicas complejas y no convencionales de una manera fácil y comprensible al punto.

Hola compañero lector,
Somos un equipo pequeño en Techiescience y trabajamos duro entre los grandes jugadores. Si te gusta lo que ves, comparte nuestro contenido en las redes sociales. Su apoyo hace una gran diferencia. ¡Gracias!